GMP là gì?
Thực hành Sản xuất Tốt hay GMP là một hệ thống bao gồm các quy trình, thủ tục và tài liệu để đảm bảo các sản phẩm sản xuất, chẳng hạn như thực phẩm, mỹ phẩm và dược phẩm, được sản xuất và kiểm soát một cách nhất quán theo các tiêu chuẩn chất lượng đã đặt ra. Thực hiện GMP có thể giúp cắt giảm thất thoát và lãng phí, tránh bị thu hồi, tịch thu, phạt tiền và ngồi tù. Nhìn chung, nó bảo vệ cả công ty và người tiêu dùng khỏi các sự kiện tiêu cực về an toàn thực phẩm.
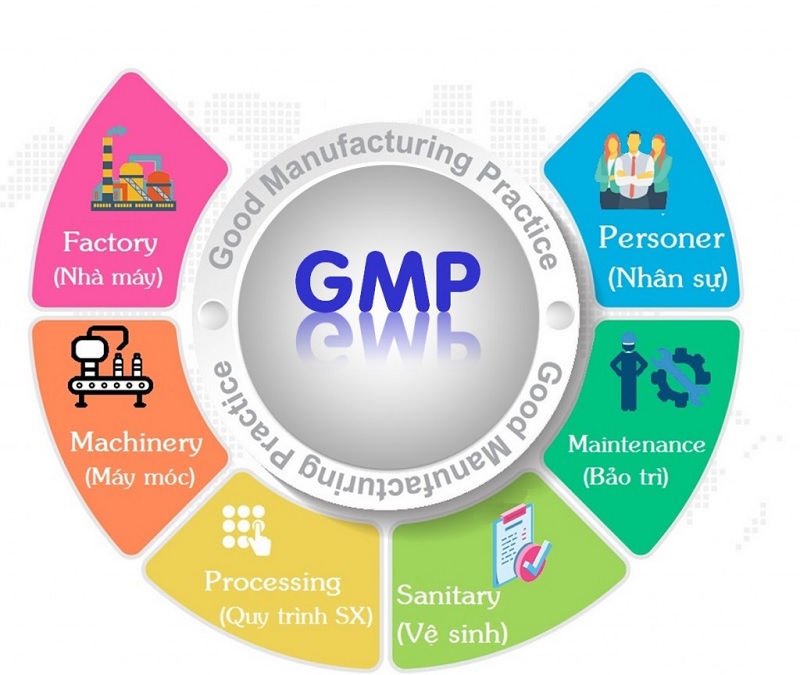
GMPs kiểm tra và bao gồm mọi khía cạnh của quá trình sản xuất để đề phòng mọi rủi ro có thể gây thảm họa cho sản phẩm, chẳng hạn như nhiễm chéo, tạp nhiễm và ghi nhãn sai. Một số lĩnh vực có thể ảnh hưởng đến sự an toàn và chất lượng của sản phẩm mà hướng dẫn và quy định GMP đề cập như sau:
- Quản lý chất lượng
- Vệ sinh và điều kiện vệ sinh
- Tòa nhà và cơ sở vật chất
- Thiết bị
- Nguyên liệu thô
- Nhân viên
- Xác nhận và trình độ
- Khiếu nại
- Tài liệu và lưu trữ hồ sơ
- Thanh tra & đánh giá chất lượng

Các loại tiêu chuẩn GMP là gì?
Tiêu chuẩn EU-GMP
là tiêu chuẩn “Thực hành sản xuất tốt – EU” được cấp bởi EMA – Cơ quan quản lý Dược phẩm châu Âu. Đây là một trong các loại tiêu chuẩn GMP chịu trách nhiệm về đánh giá khoa học, kiểm tra và giám sát an toàn các loại thuốc trong EU.
Tiêu chuẩn GMP WHO
là hướng dẫn thực hành tốt sản xuất thuốc do tổ chức y tế thế giới xây dựng và phát hành đầu tiên vào năm 1968. Đây là tiêu chuẩn được hầu hết các cơ sở sản xuất thuốc ở Việt Nam áp dụng và thực hiện theo.
Tiêu chuẩn cGMP
là tiêu chuẩn được áp dụng trong các nhà máy sản xuất, xưởng sản xuất, cơ sở sản xuất,… nhằm đảm bảo chất lượng và an toàn cho sản phẩm.

Sự khác biệt giữa GMP và cGMP là gì?
Thực hành Sản xuất Tốt (GMP) và Thực hành Sản xuất Tốt (cGMP) hiện tại có thể thay thế cho nhau. GMP là quy định cơ bản do Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) ban hành theo thẩm quyền của Đạo luật Thực phẩm, Dược phẩm và Mỹ phẩm Liên bang nhằm đảm bảo rằng các nhà sản xuất đang thực hiện các bước chủ động để đảm bảo sản phẩm của họ an toàn và hiệu quả. Mặt khác, cGMP được FDA thực hiện để đảm bảo cải tiến liên tục trong cách tiếp cận của các nhà sản xuất đối với chất lượng sản phẩm. Nó ngụ ý cam kết không ngừng đối với các tiêu chuẩn chất lượng cao nhất hiện có thông qua việc sử dụng các hệ thống và công nghệ cập nhật.
5 nội dung yêu cầu chính của tiêu chuẩn GMP
Đối với các tiêu chuẩn GMP trong ngành dược, doanh nghiệp sản xuất cần thực hiện và đảm bảo các yêu cầu sau:
- Yêu cầu nhân sự: Nhân sự cần được sắp xếp và đánh giá phù với năng lực, trình độ. Cùng với đó là xây dựng các quy định nghiêm ngặt về quy trình kiểm tra sức khỏe gồm các hạng mục như trí lực, thể lực, bệnh tật của nhân sự, đặc biệt là các công nhân sản xuất trực tiếp.
- Yêu cầu về thiết kế, xây dựng, lắp đặt nhà xưởng và máy móc, thiết bị chế biến: Doanh nghiệp sản xuất cần quy định rõ ràng về vị trí xây dựng nhà máy, vị trí lắp đặt thiết bị để đảm bảo hiệu quả tạo ra các sản phẩm chất lượng, an toàn.
- Yêu cầu kiểm soát vệ sinh nhà xưởng, môi trường: Nguồn nước đầu vào, xử lý nước thải đầu ra, sản phẩm phụ, rác thải để đảm bảo vệ sinh môi trường và nhà xưởng là yếu tố đặc biệt quan trọng mà doanh nghiệp cần chú trọng. Đây là tiêu chuẩn GMP bắt buộc để doanh nghiệp có thể sản xuất dược phẩm đảm bảo vệ sinh và chất lượng.
- Yêu cầu về kiểm soát quá trình chế biến: Các doanh nghiệp cần thực hiện nghiêm túc việc xây dựng quy định về phương pháp chế biến cũng như thủ tục, hướng dẫn công việc cụ thể và đảm bảo các tiêu chuẩn về nguyên liệu, công thức pha chế. Đặc biệt, doanh nghiệp cũng cần các biện pháp giám sát và kiểm tra trong quá trình sản xuất thuốc.
- Yêu cầu về kiểm soát quá trình bảo quản và phân phối sản phẩm: Các doanh nghiệp sản xuất thuốc, dược phẩm cần đưa ra yêu cầu về việc bảo quản, vận chuyển sao cho thành phẩm không bị nhiễm bẩn hay bị tác động bởi các tác nhân hóa học, vật lý, vi sinh và không thay đổi chất lượng.
Quy trình chứng nhận GMP
Bước 1: Cơ sở sản xuất gửi hồ sơ đăng ký kiểm tra GMP gửi về Cục Quản lý Dược Bộ Y tế
Bước 2: Cục quản lý Dược tiếp nhận, kiểm tra và thẩm định hồ sơ. Nếu hồ sơ chưa đáp ứng yêu cầu, Cục sẽ có văn bản yêu cầu cơ sở bổ sung.
Bước 3: Trong thời gian 60 ngày kể từ ngày nhận hồ sơ hợp lệ, Cục quản lý Dược có quyết định thành lập đoàn kiểm tra các hoạt động của cơ sở sản xuất theo các nguyên tắc tiêu chuẩn GMP-WHO cũng như các quy định chuyên môn hiện hành. Biên bản kiểm tra cần phải được phụ trách cơ sở cùng với trưởng đoàn kiểm tra ký xác nhận.
Bước 4: Nếu kết quả kiểm tra đáp ứng theo yêu cầu GMP thì cơ sở sẽ được cấp giấy chứng nhận, còn trong trường hợp cơ sở còn một số tồn tại có thể khắc phục được thì trong vòng 2 tháng kể từ ngày được kiểm tra, cơ sở phải khắc phục, sửa chữa và báo cáo kết quả khắc phục những tồn tại để gửi về Cục quản lý Dược. Đối với cơ sở chưa đáp ứng nguyên tắc, tiêu chuẩn GMP-WHO, cơ sở sản xuất sẽ cần tiến hành khắc phục, sửa chữa các tồn tại và nộp hồ sơ đăng ký như đăng ký kiểm tra lần đầu.
Bước 5: Cấp giấy chứng nhận cho cơ sở đăng ký
Hồ sơ xét Tiêu chuẩn GMP
- Bản đăng ký tái kiểm tra Thực hành tốt sản xuất thuốc (Mẫu số 02/GMP)
- Báo cáo những thay đổi của cơ sở trong 2 năm triển khai Thực hành tốt sản xuất thuốc
- Báo cáo hoạt động của cơ sở trong 2 năm qua
- Báo cáo khắc phục các tồn tại trong biên bản kiểm tra lần trước
- Báo cáo tóm tắt về huấn luyện, đào tạo của cơ sở trong 2 năm qua
- Báo cáo tự thanh tra và đánh giá của cơ sở trong đợt gần nhất (trong vòng 3 tháng) về triển khai Thực hành tốt sản xuất thuốc
Cùng với 4 tiêu chuẩn thực hành tốt GPs trong ngành Dược, GMP là tiêu chuẩn vô cùng quan trọng mà các cơ sở sản xuất thuốc, thực phẩm chức năng cần quan tâm. Sapo hy vọng rằng những chia sẻ trên của chúng tôi sẽ giúp bạn hiểu rõ về tiêu chuẩn GMP trong ngành Dược là gì để quản lý và tối ưu hoạt động sản xuất của các cơ sở một cách hiệu quả nhất.
https://drive.google.com/file/d/188-t6myit132hBt_1WFMvTA7UH38SaOH/view
Liên hệ ngay để được hỗ trợ tốt nhất:

![]() Văn phòng Hà Nội: Tầng 7 Tòa nhà HLT Số 23 Ngõ 37/2 Dịch Vọng Cầu Giấy Hà Nội
Văn phòng Hà Nội: Tầng 7 Tòa nhà HLT Số 23 Ngõ 37/2 Dịch Vọng Cầu Giấy Hà Nội
![]() Văn phòng Đà Nẵng: 73 Lý Thái Tông, Phường Thanh Khê Tây, Quận Thanh Khê, Đà Nẵng
Văn phòng Đà Nẵng: 73 Lý Thái Tông, Phường Thanh Khê Tây, Quận Thanh Khê, Đà Nẵng
![]() Văn phòng HCM: Tòa nhà PLS, 282 Chu Văn An, Phường 26, Bình Thạnh, TP.HCM
Văn phòng HCM: Tòa nhà PLS, 282 Chu Văn An, Phường 26, Bình Thạnh, TP.HCM

![]() Email: info@ggobal.vn
Email: info@ggobal.vn